La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) emitió una alerta sanitaria sobre la falsificación y comercialización ilegal de GARDASIL. 9, 10 doses (0.5 mL), una vacuna recombinante nonavalente contra el virus de papiloma humano (VPH) en suspensión intramuscular.
De acuerdo con la institución, la alerta se emitió a partir de acciones de control sanitario, así como la comparecencia del laboratorio Merck Sharp & Dohme Comercializadora y de la empresa responsable de la importación, almacenamiento y distribución de dicha vacuna en México ante la autoridad sanitaria mexicana.
Tras la comparecencia, la empresa manifestó la falsificación y comercialización ilegal del producto GARDASIL. 9, 10 doses (0.5 mL), con las siguientes características:
- Número de lote 900-1197-NDC 0006-4121-02 y fecha de caducidad DIC 25.
- Número de lote 900-1147 y fecha de caducidad JUL 25.
- Número de lote y fecha de caducidad 900-1227.
¿Cómo identificar la vacuna falsa?
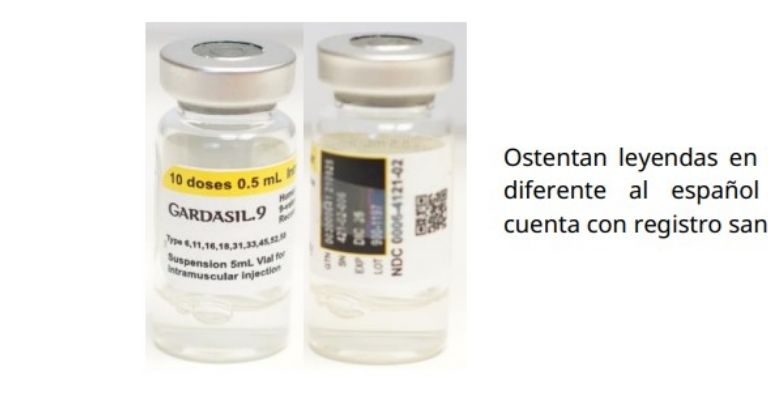
La alerta sanitaria indica que este producto no corresponde con la presentación autorizada por Cofepris y tampoco es reconocido como importado y distribuido por Merck Sharp & Dohme Comercializadora, ni fabricado por representa un riesgo a la salud de la población ya que se desconoce su procedencia, condiciones de fabricación, almacenamiento y transporte, así como las materias primas con las que fue elaborado.
Asimismo, refiere que los viales que contienen el líquido ostentan leyendas en idioma diferente al español, además de que el producto identificado como falso no cuenta con registro sanitario, lo cual representa un riesgo a la salud de la población ya que se desconoce su procedencia, condiciones de fabricación, almacenamiento y transporte, así como las materias primas con las que fue elaborado, por lo que no se garantiza la seguridad, eficacia y calidad del mismo.
Recomendaciones de Cofepris
Como parte de esta alerta sanitaria, Cofepris emite las siguientes recomendaciones.
A la población en general:
- Suspender el uso y administración de la vacuna GARDASIL. 9, 10 doses (0.5 mL), con cualquier número de lote y fecha de caducidad.
- No suministrar vacunas que ostenten idioma diferente al español y que no cuente con registro sanitario.
- Antes de suministrar esta o cualquier vacuna, siempre realizar una inspección visual del empaque secundario y primario para verificar que los números de lote y fechas de caducidad concuerden, así como al contenido para revisar que no presente alguna anomalía.
- Si se ha suministrado la vacuna GARDASIL. 9, 10 doses (0.5 mL) y ha presentado cualquier reacción adversa o malestar, reportarlo en el siguiente enlace en línea o al correo electrónico: [email protected]
A los profesionales de la salud:
- No adquirir, ni suministrar la vacuna GARDASIL. 9, 10 doses (0.5 mL), con cualquier número de lote y fecha de caducidad.
- En caso de identificar la venta de la vacuna GARDASIL. 9, 10 doses (0.5 mL), con las características antes mencionadas, no adquirirlo y de contar con información sobre su posible comercialización, realizar la denuncia sanitaria correspondiente.
- Siempre adquirir vacunas con distribuidores autorizados y validados por la empresa titular del registro sanitario, mismos que deberán contar con licencia sanitaria y aviso de funcionamiento; de igual forma, contar con la documentación de la legal adquisición del producto.
- Se recomienda consultar el Listado de Distribuidores Irregulares emitido por Cofepris, previo a la adquisición de productos.
A distribuidores de medicamentos y farmacias:
- Adquirir vacunas solo en los establecimientos formalmente constituidos, que cuenten con licencia sanitaria y aviso de funcionamiento.
- Adquirir y comercializar vacunas, que ostenten idioma al español, además que deberán contar con la documentación que garanticen la calidad y seguridad de las vacunas.
- Garantizar las condiciones de almacenamiento y transporte para que el producto no represente un riesgo sanitario.
Cortesía de El Heraldo de México.

Dejanos un comentario: